آیا کشیدن دندان در ساختار صورت تغییر ایجاد می کند؟
13 آذر ماه 1403
اشتباهات رایج در طول کاشت ایمپلنت های دندانی
12 دی ماه 1403
در این نوشته می خوانید:
سلامت دهان با ترکیب پیچیده ای از عوامل ژنتیکی، اپی ژنتیکی، محیطی و رفتاری تعیین می شود. در حالی که رژیم غذایی، تروما، سیگار کشیدن و دسترسی به مراقبت ها بر خطر بیماری های دندانی تأثیر می گذارند، تعدادی از شرایط نیز مستقیماً توسط جهش های ژنتیکی ارثی یا صفات منتقل شده در خانواده ها ایجاد می شوند. این مقاله مروری عمیق ارائه می کند بر بیماری های ارثی دندانی و اختلالات رشدی که بر ساختار دندان، تشکیل مینا و عاج، رویش و هم ترازی دندان ها، و استعداد ابتلا به پوسیدگی دندان و بیماری های پریودنتال تأثیر می گذارند.
چه بیماری های دندانی ارثی هستند؟
نقص در تشکیل مینای دندان
مینای دندان لایه بیرونی معدنی بسیار سخت و کریستالی است که آناتومی هر تاج دندان را می پوشاند و از آن محافظت می کند. مینای دندان در بین بافت ها منحصر به فرد است، زیرا پس از تشکیل، خود را بازسازی نمی کند یا تغییر شکل نمی دهد، بنابراین هر گونه نقص در طول توسعه اولیه ساختار و استحکام آن را برای همیشه تغییر می دهد. تشکیل مینای دندان در مراحل تحت کنترل دقیق ژنتیکی اتفاق می افتد، با سلول های آملوبلاست که پروتئین های ماتریکس خاصی را ترشح می کنند که فرآیند معدنی سازی و بلوغ بلورهای هیدروکسی آپاتیت را هدایت می کند.
چه بیماری های دندانی ارثی هستند؟
آملوژنزیس ایمپرفکتا Amelogenesis Imperfecta
نشان دهنده گروهی از شرایط ارثی است که باعث تشکیل معیوب مینای دندان می شود و در نتیجه مینای دندان نازک، نرم، خشن و مستعد پوسیدگی و شکستگی سریع است. این بیماری در اثر جهش در ژن های کد کننده پروتئین های ماتریکس مینا مانند آملوژنین، مینالین، مینایزین و آملوبلاستین ایجاد می شود که برای رشد مناسب مینای دندان ضروری هستند. مینای معیوب نمی تواند در برابر فرسایش طبیعی و انحلال اسید ناشی از باکتری های دهان که در دهان ایجاد می شود مقاومت کند. چهار تظاهرات فنوتیپی اصلی آملوژنزیس ایمپرفکتا وجود دارد:
- Hypoplastic هیپوپلاستیک – مینای نازک و سخت فاقد ضخامت و حجم کافی. ناشی از جهش در ژن های خاص مینا مانند AMELX، ENAM، KLK4. وراثت اتوزومال غالب.
- Hypomaturation هیپومچوریشن – مینای ناقص معدنی شده که نرم تر است، و محتوای هیدروکسی آپاتیت کمتری دارد. انواع ژن MMP20 و KLK4 اغلب دخیل هستند. توارث اتوزومال مغلوب.
- Hypocalcified هیپو کلسیفیه شده – ضخامت طبیعی مینای دندان است اما محتوای مواد معدنی بسیار کم باعث می شود نرم باشد و به راحتی از بین برود. جهش های مؤثر بر FAM83H. وراثت اتوزومال غالب.
- Hypomature-hypoplastic هیپومچور – هیپوپلاستیک – مینای دندان نازک با کمبود معدنی است. ناشی از جهش WDR72. توارث اتوزومال مغلوب.
بیش از 10 جایگاه ژنی مختلف در حال حاضر شناسایی شده اند که می توانند باعث ارث غیر سندرمی آملوژنزیس ایمپرفکتا می شوند، زمانی که نقائص مینا به صورت مجزا و بدون سایر علائم سندرمی رخ دهند. الگوهای توارث مرتبط با X، اتوزومال غالب و اتوزومال مغلوب بسته به ژن های خاص درگیر مشاهده می شوند. آزمایشات ژنتیکی و تجزیه و تحلیل شجره نامه امکان تعیین جهش های دقیق ایجاد کننده در خانواده های تحت تأثیر این اختلال نقص مینا را فراهم می کند.
هدف درمان آملوژنزیس ایمپرفکتا محافظت از مینای ضعیف و حساس در برابر تخریب اضافی است. بهداشت عالی دهان، قرار گرفتن در معرض فلوراید، اصلاح رژیم غذایی و ترمیم های رزینی برای دندان های به شدت آسیب دیده به جلوگیری از تخریب و از دست دادن سریع دندان کمک می کنند. با این حال، مینای معیوب علیرغم تلاش های مداخله ای، برای همیشه آسیب پذیر می ماند.
دنتینوژنزیس ایمپرفکتا
دنتینوژنزیس ایمپرفکتا مانند آملوژنزیس ایمپرفکتا یک اختلال ارثی است که باعث تشکیل عاج معیوب می شود و منجر به تغییر رنگ قهوه ای – کهربایی یا خاکستری – آبی می شود که مستعد ساییدگی، شکستگی و مشکلات پالپ هستند. ساختار غیر طبیعی عاج ناشی از جهش هایی است که بر پروتئین های ماتریکس کلاژن ترشح شده توسط سلول های ادنتوبلاست در طول رشد عاج در زیر لایه مینا تأثیر می گذارند.
دنتینوژنزیس ایمپرفکتا نوع 1 با دندان های قهوه ای کهربایی به دلیل جهش های اتوزومال غالب در ژن DSPP کد کننده سیالوفسفوپروتئین عاج ایجاد می شود. دنتینوژنزیس ایمپرفکتا نوع 2 با دندان های خاکستری – آبی دارای توارث اتوزومال مغلوب است که اغلب با جهش های مغلوب DSPP مرتبط است، اما می تواند شامل نقص های ژن کلاژن DDPII و COL1A1 نیز باشد. موارد شدید می تواند با نقص بافت همبند سیستمیک استخوان زایی ناقص تظاهر پیدا کند.
مانند نقص مینا، مورفولوژی ناهنجار عاج و محتوای مواد معدنی ناشی از این جهش های ژنتیکی منجر به بدتر شدن سریع سلامت دندان حتی با تلاش های جدی بهداشت دهان و دندان می شود. مدیریت شامل فلوراید تراپی سخت و ترمیم یا اصلاح شکستگی دندان است، اما نقص عاج باقی می ماند.
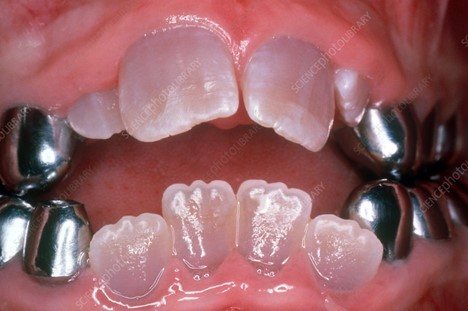
دنتینوژنزیس ایمپرفکتا
اختلالات رشدی دندانی
دیسپلازی اکتودرمال
دیسپلازی اکتودرمال نشان دهنده گروهی از بیش از 150 سندرم مادرزادی متمایز است که ناشی از نقائص ژنتیکی است که بر بافت های مشتق شده از اکتودرم مانند پوست، مو، ناخن، غدد عرق و بویژه برای سلامت دندان – دندان ها تأثیر می گذارد. جهش در فاکتورهای سیگنالینگ مانند EDA، EDAR، و WNT10A برهمکنش های متقابل مزانشیمی اپیتلیال را در طول رشد دندان مختل می کند و منجر به عدم بوجود آمدن دندان ها (هیپودنشیا)، بد شکلی دندان های نوک تیز یا مخروطی شکلی و عدم وجود مینای دندان طبیعی می شود.
اکثر موارد دارای توارث مغلوب مرتبط با X هستند، اما وراثت اتوزومال غالب و مغلوب نیز رخ می دهند. مبتلایان به موهای کم پشت، علاوه بر نقائص دندانی، مشکلات کاهش تعریق و رنگدانه های پوست را نیز دارند. مدیریت تظاهرات دهانی با هدف بازیابی عملکرد و زیبایی از طریق ایمپلنت های دندانی، ترمیم های چسبنده و پروتز انجام می شود.
ادنتودیسپلازی منطقه ای
این عارضه نادر غیر ارثی که به عنوان دندان ارثی نیز شناخته می شود، باعث ایجاد نقص های مینای سگمنتال و عاج می شود که فقط در چند دندان، اغلب در همان ربع یا ناحیه دهان، موضعی می شوند. دندان های آسیب دیده تغییر رنگ قهوه ای – زرد دارند و معمولاً نرم، متخلخل، هیپوپلاستیک و مستعد فرسایش و پوسیدگی سریع هستند. علت ناشناخته است اما ممکن است شامل اختلال عروقی یا ضربه موضعی در طول کلسیفیکاسیون دندان در رحم باشد. ترمیم های گسترده اغلب برای نجات دندان های رو به نابودی و جلوگیری از خراب شدن نیاز است.
اختلالات رشدی دندانی
دیسپلازی عاج
دیسپلازی عاج شامل تشکیل غیر طبیعی عاج ریشه و تاج است که منجر به کوتاه شدن ریشه های دندان و از بین رفتن پالپ می شود. نقص های ارثی عاج منجر به تغییر رنگ دندان ها به کهربایی مایل به قهوه ای یا خاکستری مایل به آبی با خطر بالای نکروز پالپ می شود. ناهنجاری ریشه نیز رخ می دهد. زیرگروه های اتوزومال غالب و مغلوب وجود دارند که به دلیل جهش در ژن DSPP در کروموزوم 4q ایجاد می شود. کشیدن دندان اغلب به دلیل آبسه پالپ و خطر شکستگی به طور اجتناب ناپذیری نیاز است.
شکاف کام و لب
شکاف های دهانی از جمله شکاف لب، شکاف کام یا هر دو با هم دارای یک جزء ارثی قوی با چندین مکان خطر ژنتیکی شناسایی شده هستند. شکاف زمانی رخ می دهد که بخش هایی از لب و کام طی رشد جنینی جمجمه – صورت به دلیل مهاجرت مختل شده، سلول های تاج عصبی به قوس های شاخه ای که ساختارهای صورت و فک را تشکیل می دهند، با هم ترکیب نشوند.
این اتفاق باعث ایجاد منافذ می شود که می تواند لب بالا، سقف دهان (سخت کام) و یا بخش پشتی بافت نرم کام را درگیر کند. شکاف ها اغلب باعث بروز مشکلات دندانی بعدی مانند از دست دادن دندان در نزدیکی محل شکاف، دندان های ناقص، ناهنجاری های رویش دندان و ناهماهنگی به دلیل تغییر آناتومی استخوان و بافت نرم می شوند.
داشتن شکاف به دلیل مراقبت های تخصصی ارتودنتیک و بهداشت مورد نیاز دهان و دندان، خطر پوسیدگی دندان و بیماری پریودنتال را افزایش می دهد. ترمیم جراحی لب و کام، که اغلب با پیوند استخوان بعدی همراه است، می تواند زیبایی و عملکرد طبیعی را بازگرداند، اما به طور کامل از عوارض دندانی مانند مشکلات گفتاری و ناهماهنگی جلوگیری نمی کند.
مستعد بیماری پریودنتال بودن
پریودنتیت تهاجمی
این شکل شدید و سریع بیماری لثه باعث زوال سریع الیاف پریودنتال و استخوان آلوئولار در افراد سالم می شود که معمولاً در دوران بلوغ یا اوایل بزرگسالی به آن آسیب می زند. یک مؤلفه ژنتیکی بسیار قوی دخیل است، با الگوهای وراثتی که اغلب با انتقال اتوزومال غالب سازگار است، گرچه به احتمال زیاد خطرات چند ژنی نیز نقش دارند. بدون درمان به موقع، حتی با حداقل پلاک دندانی و بهداشت عالی دهان، پریودنتیت تهاجمی اغلب منجر به از دست دادن زود هنگام دندان می شود.
به نظر می رسد جهش های ژنی متعددی که بر عوامل ایمنی، تنظیم التهاب و مسیرهای تخریب بافت تأثیر می گذارند، با افزایش مستعد پریودنتیت تهاجمی شدن مرتبط باشد. ممکن است نقائص نوتروفیل درگیر باشند، با ناهنجاری هایی در HMPO، کاتپسین C، و سایر آنزیم های لیزوزومی مشاهده می شوند. با این حال، محرک های ژنتیکی مشخص همچنان نامشخص هستند. با این حال، پریودنتیت تهاجمی به شدت در خانواده ها اتفاق می افتد و تأثیر ژنتیکی قوی جدا از بیماری مزمن لثه بزرگسالان ناشی از پلاک را تأیید می کند.
پریودنتیت مزمن
نوع معمولی بیماری لثه در افراد بزرگسال که به آهستگی از ژنژیویت مداوم ایجاد می شود، دارای عوامل خطر ژنتیکی نیز می باشد، اما به شدت تحت تأثیر قرار گرفتن در معرض محیطی قابل تغییر مانند سیگار کشیدن و دیابت کنترل نشده است. با این حال، مطالعات دوقلوها نشان می دهد که تقریباً 50% وراثت حتی برای بیماری مزمن پریودنتال وجود دارد که مؤید یک مؤلفه استعداد ارثی است. به نظر می رسد تمایلات ژنتیکی وجود دارند که تفاوت بین افراد را در پاسخ ایمنی به پاتوژن های دهان، تنظیم التهابی و تخریب بافت بر اثر چالش بیوفیلم باکتریایی به حساب می آورد.
چندین تنوع ژنتیکی ظریف شامل سطوح سیتوکین (IL-1، IL-6، TNF-alpha)، گیرنده های سلولی (گیرنده های مشابه) و آنزیم هایی مانند کلاژناز با خطر و شدت بیماری مزمن پریودنتال مرتبط هستند. به نظر می رسد انواع ژن در گیرنده ویتامین D نیز دخیل باشند. با این حال، بهداشت سخت دهان و دندان و مدیریت سایر عوامل خطر این امکان را فراهم می کنند که از بیماری مزمن لثه بدون در نظر گرفتن ژنتیک پیشگیری کرد یا آن را به حداقل رساند.
مستعد بیماری پریودنتال بودن
مستعد پوسیدگی دندان بودن
پوسیدگی دندان به خوبی در نتیجه تعامل پیچیده بین باکتری های دهان تولید کننده اسید مانند استرپتوکوک ها و لاکتوباسیل ها، کربوهیدرات های خوراکی قابل تخمیر، خواص بزاق و یکپارچگی سطح مینای دندان ایجاد می شود. با این حال، شواهدی نیز وجود دارند که حاکی از تأثیر ژنتیک بر خطر پوسیدگی دندان هستند. برخی از افراد با وجود رعایت دقیق بهداشت دهان و دندان مستعد پوسیدگی هستند، در حالی که برخی دیگر حتی با عادات ضعیف مسواک زدن دچار پوسیدگی کمی می شوند که نشان دهنده مقاومت ژنتیکی قوی تر است.
اقوام بیولوژیکی درجه یک اغلب از نرخ ها و الگوهای پوسیدگی دندانی مشابهی برخوردارند که به یک جزء استعداد ارثی اشاره می کند. تغییرات ژنتیکی خاصی شناسایی شده اند که بر شکل گیری مینای دندان، کمیت و ترکیب بزاق، ساختار شناسی حفره و شیار دندان و میکروبیوم دهان تأثیر می گذارند که همگی می توانند خطر پوسیدگی دندان را تعدیل کنند. ارزیابی خطر پوسیدگی با ترکیب نشانگرهای ژنتیکی ممکن است روزی به پیش بینی بهتر مستعد پوسیدگی بودن در مقابل انعطاف پذیری در رویکردهای پیشگیرانه کمک کند. در حال حاضر، افرادی که خطر پوسیدگی ارثی بالایی دارند، از درمان های پیشگیرانه و هوشیاری بیشتری بهره می برند.
آژنزیس دندان و عدم وجود دندان
هیپودنشیا غیر سندرمی
این عارضه به عنوان عدم وجود مادرزادی یا نروییدن 6 دندان دائمی یا بیشتر، به استثناء دندان های مولر سوم تعریف می شود. شایع ترین دندان هایی که به صورت مادرزادی وجود ندارند دندان های پرمولر دوم فک پایین، دندان های پیشین جانبی فک بالا و دندان های پرمولر دوم فک بالا هستند. هیپودنشیا در 3 تا 5 درصد از جمعیت عمومی به درجات مختلف رخ می دهد و به عنوان خفیف (فقدان 2 تا 5 دندان)، متوسط (فقدان 6 تا 9 دندان) و شدید (فقدان بیش از 9 دندان) طبقه بندی می شود.
اعتقاد بر این است که هم آسیب محیطی و هم عوامل ژنتیکی مسئول هیپودنشیا هستند و جهش در ژن های مختلف باعث اختلال در رشد فولیکول دندان می شود. اینها شامل MSX1، PAX9، AXIN2، EDA، و WNT10A در میان سایر جهش ها می شوند. نمود فنوتیپی و الگوهای وراثتی هیپودنشیا غیر سندرمی بسیار متغیر است و با خطرات چند ژنی در تعامل با تأثیرات اپی ژنتیکی و محیطی بر روی تشکیل دندان سازگار است.
الیگودونشیا Oligodontia
الیگودنشیا نشان دهنده شکل شدیدتری از آژنزیس رشدی دندان است که مشخصه ویژه آن عدم وجود 6 دندان یا بیشتر به صورت مادرزادی است، که اغلب شامل دندان های مولر اول و دوم دائمی یا دندان های دیگر می شود که به طور معمول میزان آژنزیس بسیار پایینی را نشان می دهند. این وضعیت نادر 1/0 تا 2/0 درصد از جمعیت را تحت تأثیر قرار می دهد. الگوی عدم وجود مادرزادی دندان ها می تواند شامل دندان های پیشین، دندان های نیش، دندان های پرمولر و دندان های مولر باشد.
علل ژنتیکی شناخته شده الیگودنشیای مجزا معمولاً شامل جهش هایی در MSX1، PAX9، و AXIN2 است که معمولاً در ایجاد آژنزیس مجزای دندان نقش دارند. به نظر می رسد که اینها رشد اولیه دندان را مختل می کنند، شروع جوانه زدن و مراحل معدنی شدن بعدی را مختل می کنند. الیگودنشیا اغلب الگوهای توارث اتوزومال غالب در خانواده ها را نشان می دهد، اما سایر مکان های ژنتیکی نیز ممکن است درگیر باشند. این سطح شدید عدم رویش مادرزادی دندان ها به ترمیم و توانبخشی گسترده دندانی برای ایجاد اکلوژن عملکردی نیاز دارد.
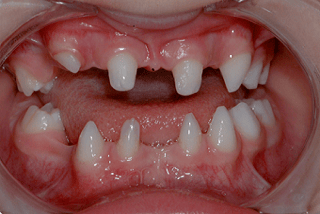
آژنزیس دندان و عدم وجود دندان
سندرم های بیماری ارثی دهان
تعدادی از شرایط سندرم ژنتیکی وجود دارند که شامل علائم متعددی هستند که بر کل بدن تأثیر می گذارند، از جمله تظاهرات دهانی مشخص. این سندرم های ارثی اغلب شامل نقص های رشدی دندان، شکاف و افزایش خطر بیماری های دندانی هستند:
- سندرم داون – تأخیر در رویش دندان، فک های کوچک تر، بیماری پریودنتال و ظاهر منحصر به فرد صورت تنفس دهانی
- سندرم مارفان – افزایش زخم های دهان، تحلیل ریشه، کلسیفیکاسیون پالپ و مشکلات TMJ بسیار متحرک
- سندرم اهلرز دانلوس – پریودنتیت زود رس بیش از 50% در سن 20 سالگی به دلیل شلی بافت و اختلال در ترمیم زخم تأثیر می گذارد.
- سندرم پاپیلون لفور – پریودنتیت به شدت زودرس با از دست دادن کامل دندان در نوجوانان، مرتبط با جهش کاتپسین C
- دیسپلازی کلیدوکرانیال – عدم وجود دندان ها، دندان های اضافی باقی مانده و عدم رشد کامل فک
نکات کلیدی
- نقائص مینای دندان مانند آملوژنزیس ایمپرفکتا دارای منشأ ژنتیکی قوی از جهش هایی هستند که ترشح پروتئین ماتریکس را در طول رشد مینا مختل می کنند.
- نقائص عاج شامل دیسپلازی عاج و دنتینوژنزیس ایمپرفکتا نیز ناشی از خطاهای ژنتیکی مؤثر بر ماتریکس کلاژن و معدنی سازی هشتند.
- سندرم های رشدی مانند دیسپلازی اکتودرمال، تظاهرات دندانی دندان های مخروطی شکل، نقص مینای دندان و هیپودنشیا شدید را نشان می دهند که به دلیل جهش های ژنتیکی باعث اختلال در تعاملات متقابل مزانشیمی اپیتلیال می شوند.
- بسیاری از سندرم های ژنتیکی دیگر دارای اثرات دهانی از جمله تغییر رشد دندان، افزایش خطر پوسیدگی و پریودنتال و شکاف هستند.
- پوسیدگی و بیماری لثه علل پیچیده ای دارند که شامل تأثیر متقابل بین استعداد ژنتیکی و مواجهه های قابل تغییر مانند رژیم غذایی و سیگار هستند.
- پریودنتیت تهاجمی و شرایطی مانند سندرم پاپیون لفور منشأ ژنتیکی بسیار غالبی را نشان می دهند، در حالی که پریودنتیت مزمن و پوسیدگی، پیوندهای ژنتیکی ضعیف تری دارند.

نکات کلیدی
سؤالات متداول
آیا پوسیدگی و حفره دندان ارثی است؟
پوسیدگی دندان در اثر تداخل بین باکتری های دهان، کربوهیدرات های قابل تخمیر، فاکتورهای بزاق و یکپارچگی مینای دندان ایجاد می شود. هیچ “ژن ایجاد کننده حفره” واحدی وجود ندارد. با این حال، تغییرات ژنتیکی خاصی که بر مینای دندان، ترکیب بزاق، مورفولوژی دندان و میکروبیوم دهان تأثیر می گذارند، احتمالاً مستعد بودن فرد در مقایسه با مقاومت به پوسیدگی دندان را تعدیل می کند. بنابراین خطرات ژنتیکی نقش دارند اما برای پوسیدگی کاملاً قطعی نیستند.
آیا بیماری لثه ژنتیکی است؟ آیا مشکلات پریودنتال ارثی هستند؟
بیماری های پریودنتال دارای عوامل خطر ژنتیکی و محیطی هستند. پریودنتیت تهاجمی با شروع زودرس، تأثیر ژنتیکی بسیار قوی با الگوهای وراثتی غالباً اتوزومال غالب در خانواده ها دارد. پریودنتیت مزمن بزرگسالان پیچیده تر است و فقط حدود 50 درصد وراثت دارد، به این معنی که عوامل رفتاری و سلامتی مانند سیگار کشیدن تأثیرات زیادی دارند. با این حال، تغییرات در ژن های التهابی و آنزیم های بافتی بر حساسیت ژنتیکی تأثیر می گذارند.
چرا مال اکلوژن و دندان های کج در خانواده ها ایجاد می شوند؟
اندازه دندان، ابعاد فک و الگوهای رشد همگی ارثی هستند و به ناهماهنگی و فشردگی دندان کمک می کنند. داشتن فک کوچک، دندان های بزرگ یا اوربایت یا اورجت مانند سایر اعضای خانواده احتمال فشردگی دندان ها را بیشتر می کند. با این حال، عادات دهانی، صدمات، رژیم غذایی، و عوامل دیگر نیز بر همراستایی دندان ها تأثیر می گذارند. در حالی که ژنتیک نقش کلیدی ایفا می کند، ارتودنسی و جراحی می تواند به صاف کردن دندان ها کمک کند.
اساس ژنتیکی پشت بیماری لثه چیست؟
تحقیقات نشان می دهند که برخی از انواع ژنی مؤثر بر واسطه های التهابی (IL-1، IL-6، TNF-alpha)، متالوپروتئینازهای ماتریکس مانند کلاژناز، گیرنده های سلول های ایمنی و فعال شدن استئوکلاست ها احتمالاً زمینه ساز افزایش مستعد عفونت های پریودنتال و تخریب بافت شدن هستند. جهش هایی که مستقیماً بر عملکرد نوتروفیل ها و مونوسیت ها تأثیر می گذارند نیز به اسکار زودرس شدید کمک می کنند. بهداشت دهان و دندان برای کنترل خطرات ژنتیکی بیماری لثه ضروری است.
چرا به نظر می رسد مشکلاتی مانند مینای ضعیف در خانواده ها وجود داشته باشند؟
تشکیل مینا از نظر ژنتیکی توسط پروتئین های ترشح شده مانند آملوژنین و مینالین کنترل می شود. جهش در ژن های کد کننده این پروتئین ها منجر به تشکیل معیوب مینای دندان و شرایط ارثی مانند آملوژنزیس ایمپرفکتا می شود. این گونه نقائص مینای دندان بسته به ژن ایجاد کننده، در خانواده هایی با الگوهای X مرتبط، اتوزومال غالب یا مغلوب منتقل می شوند. مسائل دیگری مانند شیارهای عمیق تر نیز پیوندهای ژنتیکی دارند.
نتیجه گیری
به طور خلاصه، ژنتیک نقش بسیار مهمی در بسیاری از بیماری ها و ناهنجاری های دندانی، بویژه نقص های رشدی مینا و عاج ایفا می کنند که مستقیماً از جهش های ارثی ناشی می شوند. تأثیرات محیطی مانند رژیم غذایی، سیگار کشیدن و دسترسی به مراقبت به شدت بر مستعد شرایط پیچیده چند عاملی مانند پوسیدگی و پریودنتیت مزمن بودن تأثیر می گذارند. با این حال، تغییرات ژنتیکی نیز به خطر کمک می کنند. درک مبنای ارثی برخی از مشکلات دندانی امکان پیش بینی بهتر خطرات و الگوهای خانوادگی، تشخیص زود هنگام در شرایط آشنا و رویکردهای پیشگیری سفارشی تر را فراهم می کند. با این حال، بهداشت روزانه دهان حتی با وجود عوامل خطر ژنتیکی برای حفظ سلامت دهان و دندان در بهترین وضعیت ضروری است.